Laju Reaksi Kimia: Mengenal Pengertian, Rumus, dan Faktor yang mempengaruhinya
Assalamualaikum Wr. Wb.
Hallo sobat Study Education2 semua...
Kali ini kita akan membahas tentang laju reaksi kimia. Ada banyak sekali faktor yang mempengaruhi laju reaksi kimia, serta ada beberapa rumus yang harus sobat pahami, untuk lebih jelasnya langsung saja kita lihat apa itu laju reaksi kimia ..
Keterangan :
Faktor-faktor yang Memengaruhi Laju Reaksi
Faktor-faktor yang memengaruhi laju reaksi antara lain :
1. Konsentrasi
Konsentrasi merupakan faktor penting pada laju reaksi karena memengaruhi seberapa banyak tumbukan. Yang perlu diketahui bahwa pengaruh konsentrasi pada laju reaksi bukan terletak pada konsentrasi hasil reaksi, namun terletak pada pereaksinya. Jadi, jika konsentrasi pereaksinya semakin besar pastilah akan membuat tumbukan terjadi semakin banyak. Hal tersebut akan membuat laju reaksi semakin cepat. Sebaliknya, jika konsentrasi pereaksi kecil, maka tumbukan pun terjadi semakin jarang, sehingga membuat laju reaksi juga mengecil.
2. Suhu atau Temperatur
Suhu atau temperatur merupakan faktor penentu laju reaksi. Suhu ini berperan pada pergerakan partikel-partikel. Partikel-partikel akan bergerak aktif, jika suhu dinaikkan. Sebaliknya, jika suhu diturunkan partikel tidak akan bergerak aktif. Pergerakan partikel yang aktif ketika suhu dinakkan akan membuat tumbukan yang terjadi pun lebih sering, dan sebaliknya. Seperti yang sudah diketahui, jika tumbukan semakin sering, maka laju reaksi juga akan semakin cepat, dan sebaliknya.
3. Katalis
Suatu reaksi akan terjadi dengan cepat jika melibatkan katalis. Hal tersebut disebabkan karena peran katalis sebagai zat yang berguan mempercepat laju reaksi. Keberadaan katalis ini tidak akan berubah pada akhir reaksi, karena bukan berperan sebagai pereaksi. Namun, peran katalis lebih sebagai menurunkan atau mengurangi energi aktivitas. Hal tersebut sangat berguana untuk mempermudahkan membuat suatu reaksi mencapai energi aktivasi.
4. Luas Permukaan Bidang Sentuh
Luas permukaan zat-zat yang bereaksi juga menjadi faktor penting dalam laju reaksi. Hal tersebut di karenakan luas permukaan menentukan jumlah tumbukan yang terjadi. Jika luas permukaan sentuh luas akan membuat tumbukan antara partikel dan partikel semakin besar, sehingga laju reaksi pun semakin besar pula. Sebaliknya, jika luas permukaan sentuh kecil akan membuat tumbukan antara partikel dan partikel juga kecil, dan laju reaksi pun menjadi kecil pula.
Hallo sobat Study Education2 semua...
Kali ini kita akan membahas tentang laju reaksi kimia. Ada banyak sekali faktor yang mempengaruhi laju reaksi kimia, serta ada beberapa rumus yang harus sobat pahami, untuk lebih jelasnya langsung saja kita lihat apa itu laju reaksi kimia ..
Biar tambah berkah, jangan lupa baca basmallah dulu sebelum membaca..
Bismillahirrohmanirrohim..
Pengertian Laju Reaksi
Laju reaksi adalah berkurangnya konsentrasi zat pereaksi (reaktan) atau bertambahnya zat hasil reaksi (produk) per satuan waktu. Lebih singkatnya, laju reaksi merupakan perubahan konsentrasi zat per satuan waktu.
Dari pada itu, dapat dirumuskan :
Reaksi : A→B
Ket : A = PEREAKSI & B = ZAT HASIL REAKSI
Keterangan :
Tanda (-) menunjukkan pengurangan konsentrasi reaktan
Tanda (+) menunjukkan peningkatan konsentrasi produk
Tanda (+) menunjukkan peningkatan konsentrasi produk
Dalam mempelajari laju reaksi digunakan besaran konsentrasi tiap satuan waktu yang dinyatakan dengan molaritas. Apakah yang dimaksud molaritas? Simak uraian berikut.
Molaritas sebagai Satuan Konsentrasi dalam Laju Reaksi
Molaritas menyatakan jumlah mol zat dalam 1 L larutan, sehingga molaritas yang dinotasikan dengan M, dan dirumuskan sebagai berikut.
Keterangan :
Keterangan :
n = jumlah mol dalam satuan mol atau mmol
V = volume dalam satuan L atau mL
Faktor-faktor yang memengaruhi laju reaksi antara lain :
1. Konsentrasi
Konsentrasi merupakan faktor penting pada laju reaksi karena memengaruhi seberapa banyak tumbukan. Yang perlu diketahui bahwa pengaruh konsentrasi pada laju reaksi bukan terletak pada konsentrasi hasil reaksi, namun terletak pada pereaksinya. Jadi, jika konsentrasi pereaksinya semakin besar pastilah akan membuat tumbukan terjadi semakin banyak. Hal tersebut akan membuat laju reaksi semakin cepat. Sebaliknya, jika konsentrasi pereaksi kecil, maka tumbukan pun terjadi semakin jarang, sehingga membuat laju reaksi juga mengecil.
2. Suhu atau Temperatur
Suhu atau temperatur merupakan faktor penentu laju reaksi. Suhu ini berperan pada pergerakan partikel-partikel. Partikel-partikel akan bergerak aktif, jika suhu dinaikkan. Sebaliknya, jika suhu diturunkan partikel tidak akan bergerak aktif. Pergerakan partikel yang aktif ketika suhu dinakkan akan membuat tumbukan yang terjadi pun lebih sering, dan sebaliknya. Seperti yang sudah diketahui, jika tumbukan semakin sering, maka laju reaksi juga akan semakin cepat, dan sebaliknya.
3. Katalis
Suatu reaksi akan terjadi dengan cepat jika melibatkan katalis. Hal tersebut disebabkan karena peran katalis sebagai zat yang berguan mempercepat laju reaksi. Keberadaan katalis ini tidak akan berubah pada akhir reaksi, karena bukan berperan sebagai pereaksi. Namun, peran katalis lebih sebagai menurunkan atau mengurangi energi aktivitas. Hal tersebut sangat berguana untuk mempermudahkan membuat suatu reaksi mencapai energi aktivasi.
4. Luas Permukaan Bidang Sentuh
Luas permukaan zat-zat yang bereaksi juga menjadi faktor penting dalam laju reaksi. Hal tersebut di karenakan luas permukaan menentukan jumlah tumbukan yang terjadi. Jika luas permukaan sentuh luas akan membuat tumbukan antara partikel dan partikel semakin besar, sehingga laju reaksi pun semakin besar pula. Sebaliknya, jika luas permukaan sentuh kecil akan membuat tumbukan antara partikel dan partikel juga kecil, dan laju reaksi pun menjadi kecil pula.
Persamaan Laju dan Orde Reaksi
Secara sederhana, laju reaksi berbanding lurus dengan konsentrasi di pangkatkan orde atau tingkat reaksi. Nah, untuk persamaan laju reaksi dihasilkan dari eksperimen karena laju reaksi tidak dapat diturunkan dari persamaan reaksinya.
Berikut ini umumnya reaksi :
aA + bB→cC + dD, maka diperoleh rumus sebagai berikut :
r = k [A]x[B]y
Ket :
r = Laju Reaksi
k = Tetapan Laju Reaksi (mol1-n litern-1 detik-1)
[A] = Konsentrasi molar zat A
[B] = Konsentrasi molar zat B
x = Orde (tingkat) reaksi terhadap A
y = Orde (tingkat) reaksi terhadap B
x+y = Orde (tingkat) reaksi total
Satuan k untuk orde 0 = mol liter-1 detik-1
Satuan k untuk orde 1 = detik-1
Satuan k untuk orde 2 = mol-1 liter detik-1
Orde 0, misal [x]0 = 1, berarti laju reaksi tidak bergantung pada konsentrasi x.
Baca Juga : Pengertian Ilmu Kimia dan Peranannya
Menggambarkan Grafiti Laju Reaksi
➣Reaksi orde 0, r = k [A]0 = k
Reaksi orde 0 yaiu laju reaksinya selalu sama, tidak tergantung pada konsentrasi preaksi.
➣Reaksi orde 1, r = k [A]1
Reaksi orde 1 yaitu reaksi yang laju reaksinya berbanding lurus dengan konsentrasi pereaksinya.
➣Reaksi orde 2, r = k [A]2
Reaksi orde 2 yaitu reaksi yang laju reaksinya berubah secara kuadrat terhadapa perubahan konsentrasi pereaksinya.
Jangan lupa kunjungi selalu web kami, karena akan ada selalu informasi yang sebisa mungkin akan update setiap harinya, di Study Education2. Jadi jangan lupa simpan ya linknya, jika perlu sobat share ke sobat yang membutuhkan. Dan silahkan komen di bawah jika ada pertanyaan, agar kita dapat membahasnya bersama-sama.
Semoga sobat semua dapat mengambil manfaat dari membaca artikel ini.
Assalamualaikum Wr. Wb. Terimakasih!😊
Baca Juga : Pengertian Ilmu Kimia dan Peranannya
Menggambarkan Grafiti Laju Reaksi
➣Reaksi orde 0, r = k [A]0 = k
Reaksi orde 0 yaiu laju reaksinya selalu sama, tidak tergantung pada konsentrasi preaksi.
➣Reaksi orde 1, r = k [A]1
Reaksi orde 1 yaitu reaksi yang laju reaksinya berbanding lurus dengan konsentrasi pereaksinya.
➣Reaksi orde 2, r = k [A]2
Reaksi orde 2 yaitu reaksi yang laju reaksinya berubah secara kuadrat terhadapa perubahan konsentrasi pereaksinya.
Jangan lupa kunjungi selalu web kami, karena akan ada selalu informasi yang sebisa mungkin akan update setiap harinya, di Study Education2. Jadi jangan lupa simpan ya linknya, jika perlu sobat share ke sobat yang membutuhkan. Dan silahkan komen di bawah jika ada pertanyaan, agar kita dapat membahasnya bersama-sama.
Semoga sobat semua dapat mengambil manfaat dari membaca artikel ini.
Assalamualaikum Wr. Wb. Terimakasih!😊



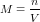



0 Response to "Laju Reaksi Kimia: Mengenal Pengertian, Rumus, dan Faktor yang mempengaruhinya"
Post a Comment